牛血清白蛋白(Bovine Serum Albumin,BSA),在体外诊断和生物药的工业生产使用中,无不熟悉。但是其来源,结构和功能,与其应用的关系,又相对较为陌生。本文结合药典要求,系统介绍,并进一步了解之。
1、血浆蛋白组成
不同种属的血液成分类似,添加有抗凝剂的全血,经过离心,可以去除血细胞,上清为血浆。血浆蛋白是动态且复杂的多蛋白,多分子类型的混合物。血浆分为组分I-V。其中组分II为球蛋白,组分IV为酶类,组分V为白蛋白,其中组分II和V为含量最大的单一性质成分。血浆蛋白最早于1937年,Tiselius通过电泳分离,并分未白蛋白,α、β、γ和δ这五类蛋白。
根据电泳技术的进步,后续Svensson和Longsworth[1,2]继续将血浆球蛋白蛋白分为α1,α2, β1,β2,γ1,γ2。在1973年,Laurell根据琼脂糖电泳,进一步将血浆蛋白分为13种主要蛋白,白蛋白,脂蛋白,抗胰蛋白,转铁蛋白,三种补体蛋白,纤维蛋白原,α1-酸性糖蛋白,珠蛋白,IgG,IgA,IgM球蛋白[3,4,5]。血浆中的蛋白来源,同样包含组织分泌的酶蛋白类,如酸性/碱性磷酸酶,淀粉酶,肽酶和核糖核酸酶等[6],见下表1:

表1
2、白蛋白结构与功能
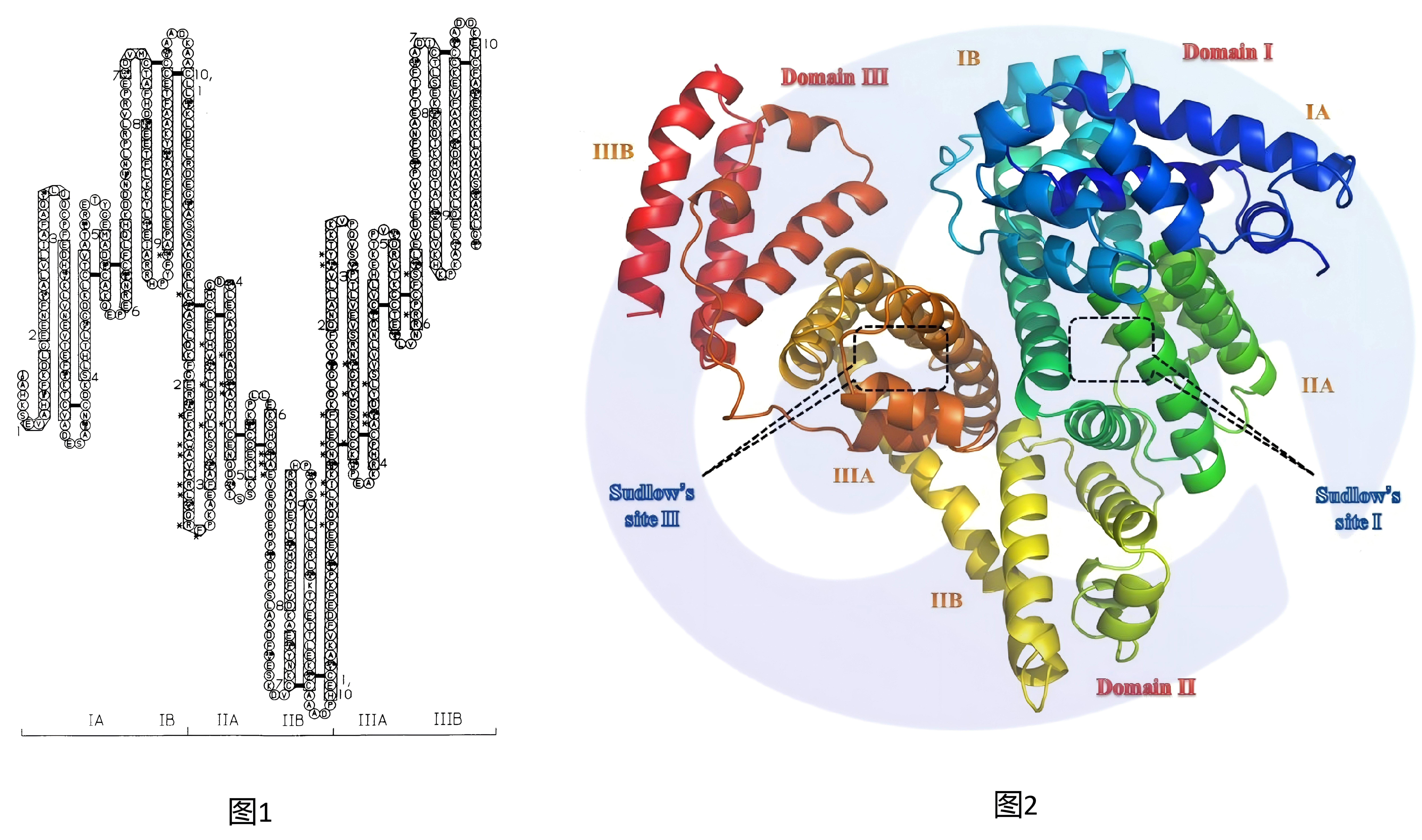
人血清白蛋白是一种单链的多聚肽,折叠成心形的蛋白,三维构象显示其包含三个结构域,每个结构与包含A和B两个亚结构域,总分子量为66.8kDa[7,8,9]。
白蛋白含有结合位点Sulow's I/II,或者每个结合位点都分别由两个loop结构形成,进一步形成IIA和IIIA亚基。报道的治疗性化合物都是结合在HSA的下述两个位点上[10,11,12,13],见下图1、2。
实质上,人、牛和大鼠的白蛋白的氨基酸成分也有略微的差异[14],见表2。在哺乳动物的白蛋白中,有着甲硫氨酸,甘氨酸和异亮氨酸含量低的特点,但是半胱氨酸、亮氨酸、离子型氨基酸、谷氨酸和赖氨酸含量丰富。因为含有大量的离子残基,导致白蛋白在pH=7条件下,有着185个离子/分子的高电荷,使白蛋白有很好的溶解性。
在肝脏中合成的白蛋白不是糖蛋白,仅仅由氨基酸组成,没有辅基和其他修饰。即便在血浆中的转甲状腺素蛋白(前白蛋白,一种专门运送视黄醇和甲状腺激素T4的白蛋白前体)几乎没有糖基基团。也缺乏Asn-X-Ser/Thr这种用于N糖基化修饰的基序。
在循环系统中的白蛋白,会有非酶类修饰成的糖基化积累,其中有一部分“糖基化修饰”是紧密结合的底物。一些混合的隐蔽的二硫键来源于半胱氨酸和谷氨酰胺,除非它们被氧化和消除,否则会被对白蛋白有轻微的影响。在正常人体内,有1%的白蛋白会和葡萄糖形成共价键结合。白蛋白的糖修饰含量已经成为白蛋白纯度的判断标准,纯净的白蛋白糖修饰含量不高于0.05%(w/w)[15]。缺少糖和酪氨酸意味着糖蛋白产生了酸水解成了黑色沉淀物或腐殖质。白蛋白通常是无色的,但是和高铁血红素,胆红素底物亲和后的浓缩溶液,会呈现黄色的特点。
表2
在代谢方面,由于白蛋白足够大,所以不至于会被肾小球过滤而流失。所以,白蛋白被用来携带脂肪酸,甾体化合物,胆红素和卟啉类化合物等治疗性药物。同时,也可以携带纳米颗粒,递送到多种大分子药物到靶细胞/器官。例如,2005年,FDA通过的抗肿瘤的白蛋白紫杉醇,即是白蛋白携带130nm颗粒和低水溶性药物递送到乳腺癌组织[16]。非甾体抗炎药(NSAID)的活性代谢产物,6-甲氧基-2-萘乙酸,和标记有碘-123的碘非他胺,以白蛋白载体游离于血浆中,穿透血脑屏障,降低了半衰期,在靶组织中富集药物,且能够很快清除放射性元素[17,18],见下图3。
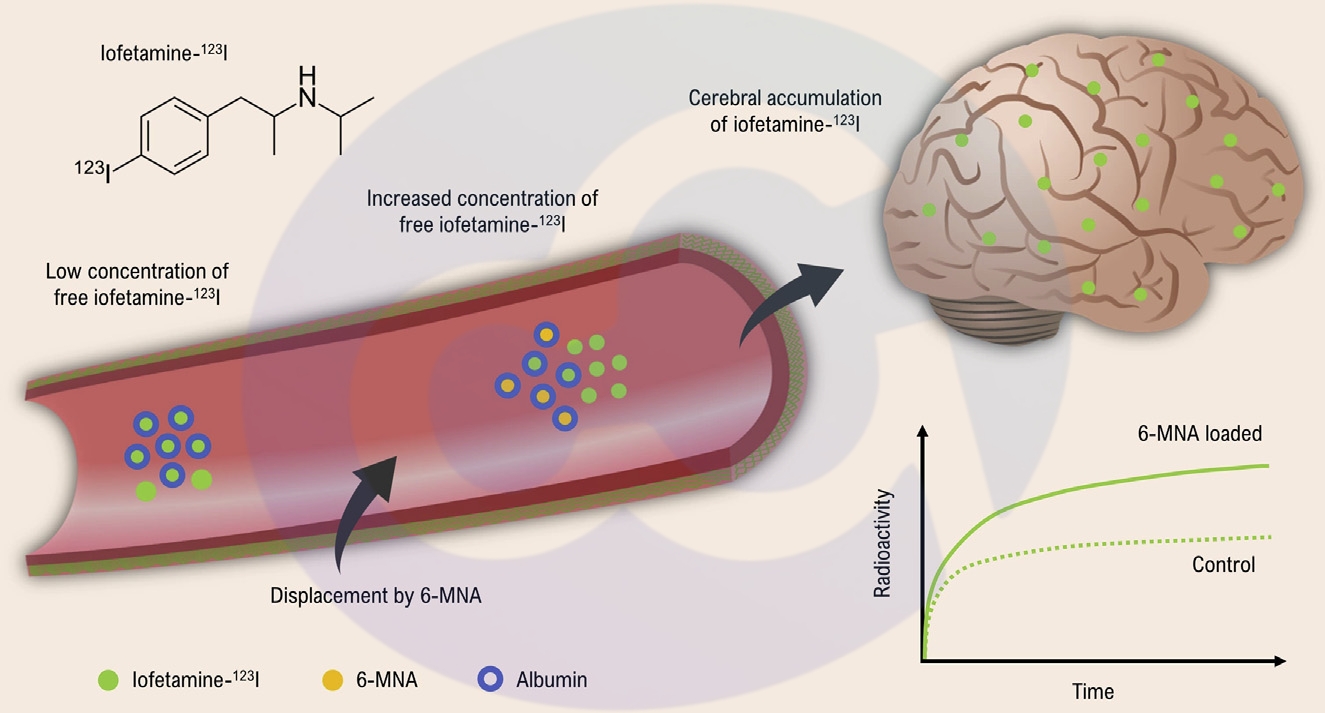
图3
血浆中的转运蛋白,包含多种,且能够分别转运不同的底物,如白蛋白(Metals, bile pigments, hormones, fatty acids, uric acid, drugs, dyes,游离乙酰胆碱等),α脂蛋白(Phospholipids, cholesterol, fatty acids),Retinol-binding globulin(Retinol (vitamin A)),Immunoglobulins(Homologous antigens),参考下表3:
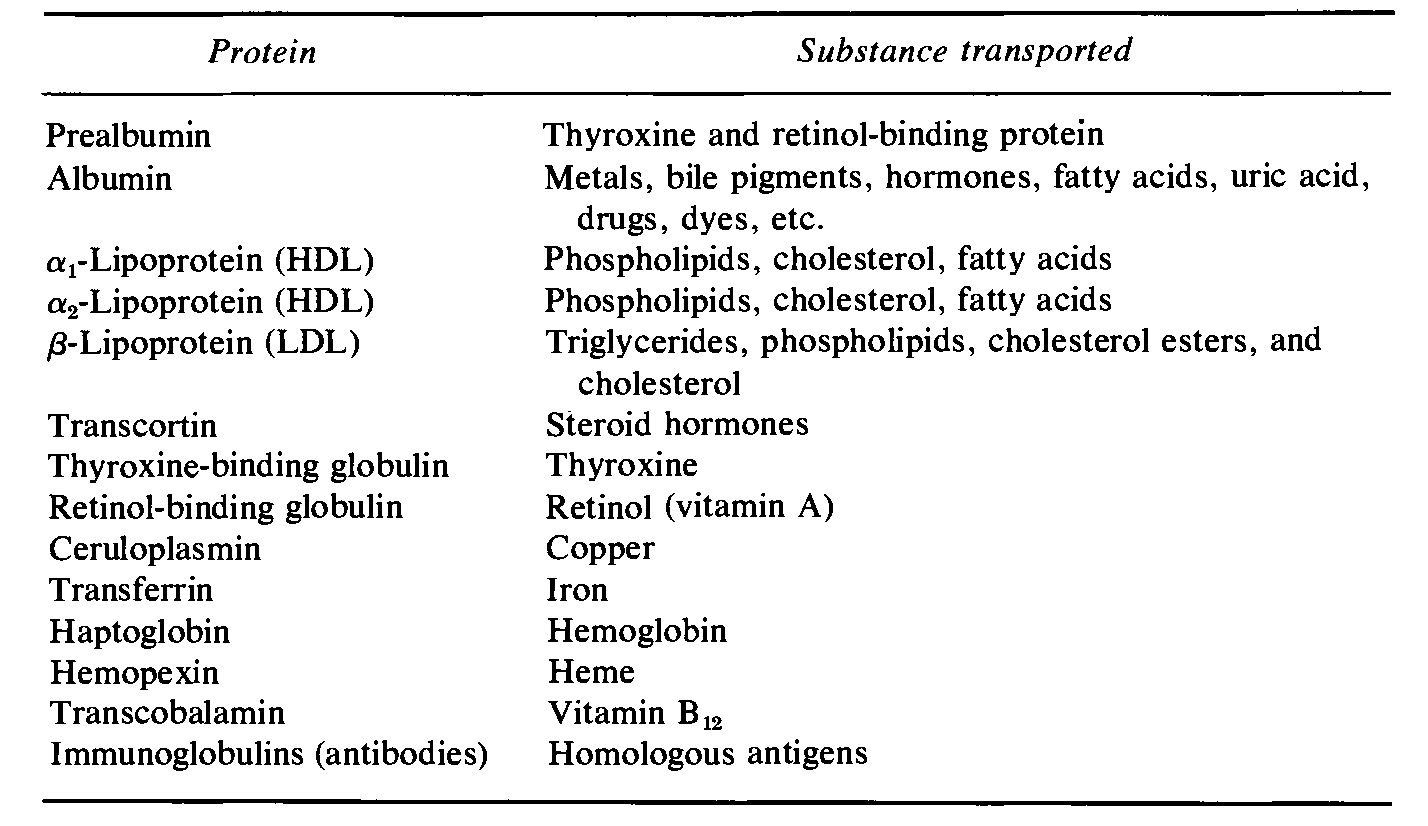
表3
鉴于上述白蛋白功能,白蛋白不仅是维持血浆渗透压和营养平衡的重要球蛋白。血浆中,多种成分也都是通过结合白蛋白进行转运。所以,人血白蛋白常作为药物,对手术等类型的病人作为营养补充,或者作为药物的添加辅料使用。
3、BSA的诊断与检测
BSA在医疗诊断传感器和酶反应等应用非常广泛。且BSA是作为蛋白定量(如BCA、Bradford)试剂,同时,由于该蛋白的准确、快速、灵敏和可重复性,所以BSA也是免疫化学检测的标准品溯源最常用的工具试剂。现在常用的BSA检测方法含有电化学阻抗谱,近红外反射光谱,毛细管电泳和光散射等技术。
人血浆白蛋白与牛血浆白蛋白的结构高度类似。BSA是牛健康、牛奶和肉质的重要标志物。而且在多种工业行业中,也有重要的应用,如药品,制药,诊断和食品等。如细胞培养过程中,牛血清作为重要的提取物,能够促进细胞渗透压维持与细胞分裂生长,同时,在多种试剂中,BSA都是作为保护性的惰性蛋白,来防止目标蛋白降解,或者能够降低诊断试剂检测样本中的抗干扰成分。
最初的毛细管电泳法检测BSA,是基于BSA中的色氨酸、酪氨酸和苯丙氨酸的存在,使之基于差异化荧光技术检测成为了可能[19]。目前主要基于Bradford法(总蛋白定量)和ELISA法(特异性BSA)定量蛋白。
在最新的药典中,都明确了添加的白蛋白的检测方法和含量限度。值得注意的是,由于BSA是实验室常用试剂,其检测污染频繁存在,实验过程中,需要重新清洁所需设备,和独立实验环境。我们配备了专用手动操作洗液,能够保持本底的稳定。
BSA作为药物常用辅料,其作为外源蛋白,过量存在也会引发机体免疫反应。依据药典要求,药物中的BSA控制限度应<50ppm。所以,赛唐生物开发了牛血清白蛋白ELISA试剂盒(货号:NEGES0014),对本底要求,最低检测限,最低定量限,精密度,准确度,干扰成分等性能做了完整分析。标曲范围为0-100ng/mL;本底OD控制在0.1-0.2之间;S1/Blank>10;DL和QL:0.0625ng/mL,0.5ng/mL;精密度Intra&Inter CV:<10%,<15%;准确度:73.7%-108.3%;且在1%人血清,人白蛋白,1%明胶等基质中的回收率均控制在70%-130%范围;见图4、5,表4、5:
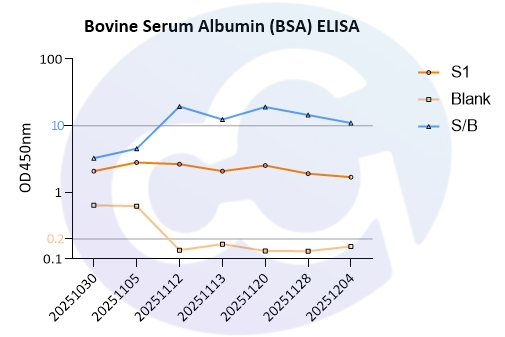
图4
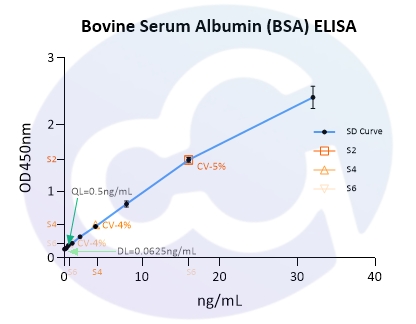
图5
|
SD Samples ng/mL |
|
|
|
|
|
|
|
|
|
2# Sample |
|
|
|
|
3# Sample |
|
|
|
|
4# Sample |
|
|
|
|
5# Sample |
|
|
|
|
6# Sample |
|
|
|
|
7# Sample |
|
|
|
|
8# Sample |
|
|
|
|
9# Sample |
|
|
|
|
10# Sample |
|
|
|
|
Mean ng/mL |
|
|
|
|
Replicate Times |
|
|
|
|
SD |
|
|
|
|
CV % |
|
|
|
|
Accuracy % |
|
|
|
表4
|
Matrix |
Diluent |
Standard ng/mL |
Recovery % |
|
1% Porcine gelatin |
1 |
16 |
106 |
|
1% Fish gelatin |
1 |
16 |
100 |
|
1% Human serum(1-16#) |
1 |
16 |
100 |
|
20ng/mL HSA |
1 |
16 |
100 |
|
DMEM |
1 |
16 |
100 |
|
DF12 |
1 |
16 |
100 |
|
PBS |
1 |
16 |
102 |
|
NaCl |
1 |
16 |
101 |
|
Tris |
1 |
16 |
97 |
|
Glucose |
1 |
16 |
92 |
表5
参考文献
[1] Svensson, H. Studies on Electrophoresis and Adsorption: I. The Moving Boundary Method in Electrophoresis and its Application to the Study of Proteins. Arkiv för Kemi, Mineralogi och Geologi. 1946. 22A (10):1-156.
[2] Longsworth, L. G. Diffusion Measurements, at 25℃, of Aqueous Solutions of Amino Acids, Peptides and Sugars. Chem. Rev. 1942. 30(2):323-340.
[3] Tiselius, A. A new apparatus for electrophoretic analysis of colloidal mixtures. Transactions of the Faraday Society. 1937. 33:524-531.
[4] Laurell C-B. Electroimmuno assay. Clin Chem. 1973. 19(1):99-102.
[5] R.L. Engle Jr., et al. The Plasma Proteins, 2, Academic Press, New York. 1960. pp184-265.
[6] Frank W Putnam. The Plasma Proteins:Structure, Function, and genetic control. New York. Second Edition / Volume I. 1975. p39.
[7] A. Jahanban-Esfahlan, et al. Spectroscopic and molecular docking studies on the interaction between N-acetyl cysteine and bovine serum albumin. Biopolymers. 2015. 103:638-645.
[8] J.K. Maurya, et al. A spectroscopic and molecular dynamic approach on the interaction between ionic liquid type gemini surfactant and human serum albumin, Journal of Biomolecular Structure and Dynamics. 2016. 34(10):2130-2145.
[9] N. Maurya, et al. In vitro cytotoxicity and interaction of noscapine with human serum albumin: Effect on structure and esterase activity of HSA. Molecular Pharmaceutics. 2019. 16(3) :952-966.
[10] A. Jahanban-Esfahlan, et al. Investigating the interaction of juglone (5-hydroxy-1, 4-naphthoquinone) with serum albumins using spectroscopic and in silico methods, Journal of the Iranian Chemical Society2017. 7(14):1527-1540.
[11] M. Kumari, et al. Effect of N-butyl-N-methyl-Morpholinium bromide ionic liquid on the conformation stability of human serum albumin. ChemistrySelect. 2017. 2(3):1241-1249.
[12] R. Patel, et al. Esterase activity and conformational changes of bovine serum albumin toward interaction with mephedrone: Spectroscopic and computational studies, Journal of Molecular Recognition. 2018. 31(11):e2734.
[13] Patel, M.U.H. et al. Spectroscopic and molecular modelling analysis of the interaction between ethane-1, 2-diyl bis (N, N-dimethyl-N-hexadecylammoniumacetoxy) dichloride and bovine serum albumin, Luminescence. 2015. 30(8):1233-1241.
[14] Theodore Peters Jr. The Albumin Molecule: Its Structure and Chemical Properties. Biochemistry, Genetics, and Medical Applications. 1995. p. 9-75, I-II.
[15] Hughes, W. L. et al. The Proteins. Academic Press, New York. 1954. 2:663.
[16] A. Jahanban-Esfahlan, et al. A simple improved desolvation method for the rapid preparation of albumin nanoparticles. International Journal of Biological Macromolecules. 2016. 91:703-709.
[17] Kawai, K., et al. Serum protein binding displacement: Theoretical analysis using a hypothetical radiopharmaceutical and experimental analysis with 123I-N-isopropyl-p-iodoamphetamine. Nuclear Medicine and Biology. 2009. 36(1):99e106.
[18] Rimac, H., et al. Displacement of drugs from human serum albumin: From molecular interactions to clinical significance. Current Medicinal Chemistry. 2017. 24(18):1930e1947.
[19] A. Jahanban-Esfahlan, et al. Interaction of glutathione with bovine serum albumin: Spectroscopy and molecular docking. Food Chemistry. 2016. 202:426-431.
